近日,根據(jù)NMPA官網(wǎng)顯示����,恒瑞申報的3類仿制藥格隆溴銨注射液的上市申請(受理號:CYHS1800093)已經(jīng)處于"在審批"狀態(tài),預(yù)計近期獲批上市�。
近日,根據(jù)NMPA官網(wǎng)顯示��,恒瑞申報的3類仿制藥格隆溴銨注射液的上市申請(受理號:CYHS1800093)已經(jīng)處于"在審批"狀態(tài)��,預(yù)計近期獲批上市�����。該藥用于肌內(nèi)或靜脈注射����,用于胃腸道疾病或**。
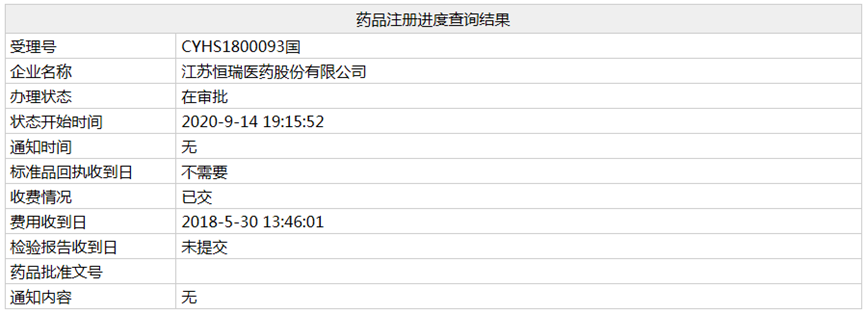
(資料來源:NMPA)
恒瑞將拿下首仿
格隆溴銨為抗膽堿藥�,其周圍作用類似阿托品。能選擇性作用胃腸道����,有較強抑制胃液分泌作用,可直接用于肌內(nèi)或靜脈注射�,用于胃腸道疾病或**。該產(chǎn)品由West-Ward Pharmaceuticals研發(fā)�����,于1982年在美國獲批上市��。當(dāng)前在美國境內(nèi)�����,格隆溴銨注射液的主要生產(chǎn)廠商包括Hikma�、American Regent等,2017年該藥品美國銷售額約1.8億美元����。
目前,國內(nèi)僅有格隆溴銨片上市��,還未有格隆溴銨注射液獲批上市�。截至目前,共有4家藥企提交上市申請��,分別是恒瑞����、苑東生物、嘉博制藥以及海岸藥業(yè)�����。
其中,恒瑞于2018年6月提交格隆溴銨注射液的上市申請��,是最早提交的藥企����。
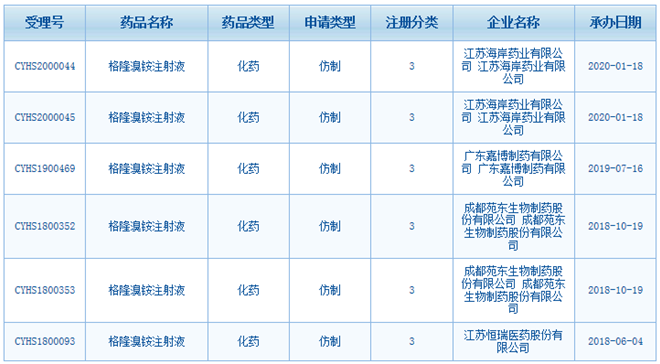
(資料來源:CDE)
2018年9月�,恒瑞的格隆溴銨注射液以"具有明顯治療優(yōu)勢創(chuàng)新藥"為由被納入優(yōu)先審評,也是唯一一家被納入優(yōu)先審評的���。

(資料來源:CDE)
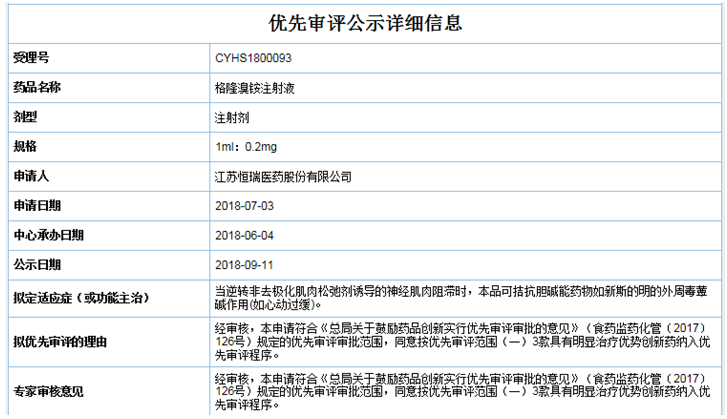
(資料來源:CDE)
值得一提的是�����,早在2018年11月�,華海藥業(yè)的格隆溴銨注射液的ANDA申請就獲美國FDA批準(zhǔn)�����,但華海目前還未在國內(nèi)提交上市申請�����。

(資料來源:巨潮資訊網(wǎng))




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號-57
2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號-57